שינויי עומק בתעשיית הביופארמה העולמית עשויים להביא את הפריצה המיוחלת של תעשיית הביופארמה בישראל. כיצד מממשים את היתרון התחרותי של ישראל בעידן של רפואה מותאמת אישית?
הקדמה: עתיד הרפואה מתחיל בישראל | ד”ר קירה רדינסקי
“תיקון עולם” הוא מושג מרכזי במסורת הישראלית, הקורא לשיפור העולם ולבניית חברת מופת. מדינת ישראל הוכיחה את מסירותה לצדק חברתי לאורך השנים במערכת הבריאות שבנתה, שסיפקה לאורך שנות פעילותה טיפול רפואי איכותי ואוניברסלי ובו בזמן השכילה לייצר תשתית מידע רפואי מפוארת. מידע זה הצטבר לאורך עשרים השנים האחרונות, והוא משמש כיום בסיס לפריצות דרךבאופן אספקת השירותים הרפואיים לאזרחי ישראל.
רפואה מונעת מבוססת בינה מלאכותית
בפעם הראשונה בהיסטוריה, מערכת רפואית יכולה לחקור את מטופליה באופן סטטיסטי ולאורך זמן, וכן לספק תובנות ממאגרי נתונים גדולים, כדי לחזות טוב יותר מחלות ומומים. רפואה מונעת מקבלת מקום מרכזי באקוסיסטם הביו-רפואי בישראל, כאשר חברות הזנק ויוזמות שנולדות בארגוני הבריאות מפתחות פתרונות דיגיטליים שיסייעו ויגנו על בני אדם ממחלות כרוניות כבר עם לידתם. כך למשל, קופת חולים כללית מפתחת כלים לניטור מחלות ולניבוי סיכון למחלה הלוקמיה, וקופת חולים מכבי מציגה מערכת בינה מלאכותית המסוגלת לספק הסתברות לנוכחות סרטן המעי הגס בעזרת בדיקת דם פשוטה.
טיפול מותאם אישית מבוסס מידע קליני וגנומי
שפע הנתונים שהצטברו במהלך השנים בישראל סולל את הדרך לרפואה מותאמת אישית. דוגמא לכך היא קופת חולים מכבי המפתחת כלים להתאמת טיפול תרופתי אישי לחולים הסובלים מיתר לחץ דם. על בסיס הנתונים הקיימים על החולים במערכת הבריאות (כגון, לחץ דם התחלתי ורקע משפחתי), ניתן כיום, בזמן אמת, להציג המלצות לטיפול רפואי, ולתת תרופות אשר עשויות להשפיע בצורה מיטבית על חולים ספציפיים.
זאת ועוד, חברות ישראליות רבות מפתחות טיפולים מותאמים אישית על בסיס גנטיקה. חברות דוגמת FDNA, חמושות במסדי נתונים גנומיים מקיפים, ממנפות בינה מלאכותית לזיהוי דפוסים פיזיולוגיים החושפים שינויים גנטיים שגורמים למחלות. חברות כאלו יכולות לחולל מהפכה ברפואה מונעת ובטיפולים מותאמים אישית על בסיס מבט אל פניו של החולה בלבד.
פריצות דרך רפואיות המבוססות על ביג דאטה (BIG DATA) ובינה מלאכותית
הנתונים שנצברו על ידי המערכת הרפואית מספקים תובנות רפואיות שיכולות לשרת לא רק את אזרחי ישראל, אלא גם להביא לפריצות דרך עולמיות ברפואה. לדוגמה, מספר מחקרים ישראלים עוסקים כעת בפיתוח אלגוריתמים לזיהוי תרופות שיש להן קשר סיבתי לסימפטומים שליליים.
מערכות תומכות החלטה
נוכח המחסור הגובר ברופאים ובצוותים רפואיים בעולם, העושר בנתוני המטופלים האנונימיים שהצטברו במערכת האקולוגית בישראל, מהווה בסיס לפיתוח כלי אבחון אוטומטיים שמייצגים את עתיד הרפואה העולמית. דוגמאות לכך ניתן למצוא בפתרונות רדיולוגיים אוטומטיים מפותחים על ידי חברות ישראליות כגון ZebraMed ו-AIdoc, המספקות כלי תמיכה לאבחון וניתוח נתונים בקרב ספקי שירותי רפואה.
עולם הבריאות עומד בפני מהפכה היסטורית. עובדה ידועה היא שמהפכות נובעות מצורך, והמערכת הרפואית העולמית זקוקה כיום לשינוי רדיקלי: אוכלוסיית העולם גדלה ומתבגרת, והגישה המוגבלת של חלקים ממנה לרפואה מגבילה את הסיכויים שלנו לחברה הוגנת, שבה לכל בני האדם זכות שווה לחיות. ישראל מצוידת ביכולות ובמשאבים להוביל שינוי ברפואה העולמית עתידית ולהביא את ה”תיקון עולם”, הלכה למעשה.
הכותבת היא דירקטור מדעי הנתונים של ebay והמדענית הראשית של החברה בישראל
נקודת המפנה של תעשיית הביופארמה בישראל?
מהפכת המידע והמיכון ברפואה שתוארה בהקדמה מחוללת שינויים דרמטיים בכל ענפי הבריאות – ובהם גם תעשיית הביופארמה העולמית, שצמאה לטכנולוגיות חדשניות. בפרט, גישת הרפואה המותאמת אישית הולכת ומתבססת בתעשייה, כאשר השילוב בין חדשנות בביולוגיה ובגנטיקה ובין התפתחויות בבינה מלאכותית וביג דאטה (Big Data) משנה את כל תהליך פיתוח התרופה. מגמה זו מטשטשת את הגבולות בין תחום הביופארמה ה”קלאסי” ובין תחום טכנולוגיות המידע.
בישראל, מצוינות ארוכת שנים במדע ביו-רפואי טרם הבשילה לתעשיית ביופארמה מקומית בוגרת. המגמה המתוארת מייצרת הזדמנות למנף את המדע הביו-רפואי הישראלי ואת ההובלה הישראלית בטכנולוגיות מידע לפיתוח מרכז טכנולוגי עולמי בתחום הרפואה המותאמת אישית. בפרק זה נתאר את השפעתה של גישת הרפואה המותאמת אישית על תעשיית הביופארמה העולמית, ונציג את חזון רשות החדשנות לרתימתה כמנוע צמיחה משמעותי לאקוסיסטם הביופארמה הישראלי.
תעשיית הביופארמה העולמית עוברת שינוי עמוק
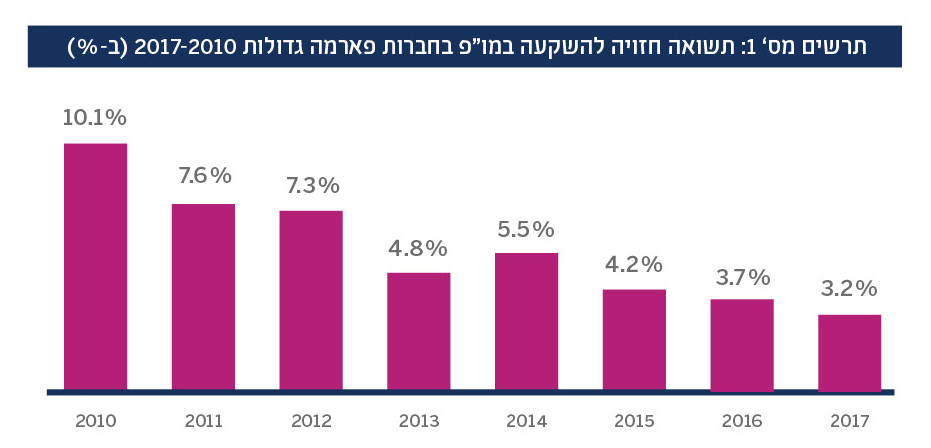
בשנים האחרונות נראה כי המודל העסקי המסורתי לפיתוח תרופות, ששיפר דרמטית את רווחת האנושות במאה האחרונה והצמיח את ענקיות הביופארמה הגלובליות, הגיע לפרשת דרכים. מספר הפיתוחים הנמצאים בשלבים מתקדמים ב”צנרת המו”פ” (pipeline) של חברות הביופארמה הגדולות מידלדל, בעוד שעלויות הפיתוח הולכות ומאמירות. אינדיקציה לכך היא התשואה על השקעה במחקר ופיתוח בתעשיית הביופארמה העולמית, אשר ירדה באופן רציף בעשור האחרון מ-10% בשנת 2010 לכ-3% בשנת2017. 1
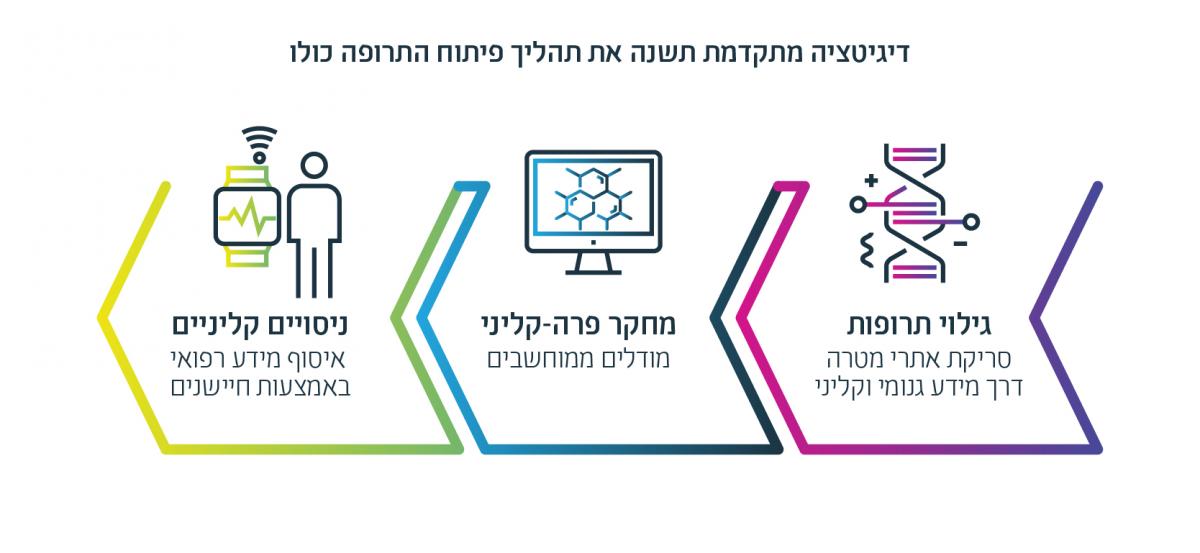
אך שינוי משמעותי העומד בפתח מבטיח להעלות את תעשיית הביופארמה שוב על מסלול החדשנות: התבססותה של גישת הרפואה המותאמת אישית. גישה זו לוקחת בחשבון את השונות הגדולה בין בני אדם בגנטיקה, סביבה וסגנון חיים, והיא נשענת על חדשנות פורצת דרך בביולוגיה וגנומיקה יחד עם התפתחויות בביג דאטה ובחישוביות. גולת הכותרת שלה כיום היא טיפול בסרטן – משפחת מחלות בהן מוטציות גנטיות הן מרכיב מרכזי, אולם היא צפויה להתרחב לתחומים רפואיים נוספים, ולשנות תהליך פיתוח התרופות כפי שאנו מכירים אותו במגוון דרכים.
ראשית, שלב גילוי התרופות (drug discovery) צפוי להשתנות כליל. ניתוח ביג דאטה רפואי ממגוון מקורות, ובפרט חיבור בין רשומות רפואיות (EMR/EHR), מידע גנומי ומידע פונקציונלי ברמת החלבון (נתוני OMICS) – יאפשר לחוקרים וחברות לזהות אתרי מטרה (targets – לדוגמה, חלבון בעייתי בתא) לתרופות חדשות ביתר קלות ומהירות. במקביל, טכנולוגיית CRISPR המהפכנית, המאפשרת עריכה ותיקון גנומי, עשויה להפוך לכלי חדש ועוצמתי לגילוי אתרי מטרה לתרופות חדשות, משום שהיא מספקת דרך חדשנית לזהות גנים וחלבונים שגורמים למחלות או מונעים אותן.2
שנית, תרופות חדשות יפותחו וייוצרו באופן מדויק יותר, שיבטיח בטיחות ואפקטיביות מיטבית. בפרט, מודלים ממוחשבים של תהליכים ביולוגיים יוכלו לייצר מידע שיסייע לצלוח את השלב הפרה-קליני בפיתוח תרופה, לעצב ולנהל ניסויים קליניים טוב יותר, ואולי אף להחליף חלק מהמידע הקליני הנדרש לאישור תרופה. בנוסף, טכנולוגיות ייצור תרופות חדשניות כגון הדפסת תלת-ממד של מרכיבי התרופה יאפשרו לשלוט ברעילות של תרופות חדשות באופן שיקל על תהליך הפיתוח כולו ועל יציאת התרופה לשוק.
שלישית, טכנולוגיות מידע מתקדמות ישנו את שלבי הניסויים הקליניים עצמם. כיום, משך הפיתוח הקליני הממוצע הוא 7.5 שנים, ועלותו נעה בין מאות מיליונים למילארדי דולרים. שימוש בטכנולוגיות מידע מתקדמות יאפשר התייעלות משמעותית בתהליך זה: ניתן יהיה לבחור את המטופלים המתאימים ביותר לניסוי על בסיס מידע גנומי וקליני ממקורות שונים (ביג דאטה); ניתן יהיה לנטר את המשתתפים בניסוי על בסיס שימוש בחיישנים מסוגים שונים אשר ישדרו מידע אלקטרוני על מדדים פיזיולוגיים שונים של המטופל; וחברות ביופארמה יוכלו לבחון את השפעת התרופות לאחר שיווקן וכך ולצמצם את עלויות שלב הניסויים הקליניים.3
השינויים הטכנולוגיים המתוארים מביאים עמם שינויים רגולטוריים משמעותיים. היכולת לפתח תרופה המותאמת לאוכלוסייה מסוימת, להבטיח את בטיחותה ולהוכיח את האפקטיביות שלה באופן יעיל ומדויק – סוללות את הדרך לתהליכי אישור מהירים יותר, חכמים יותר וזולים יותר. ואכן, גופי הרגולציה בעולם נערכים למגמה זו ונפתחים למודלים חדשים של בחינת תרופות המתאימים לעידן הרפואה המותאמת אישית. כך, לדוגמה, ה-FDA האמריקאי, הארגון הרגולטורי המשפיע ביותר בעולם הביופארמה, פתח מסלול אישור תרופות קצר יותר לטיפולים למחלת הסרטן, ויאפשר לרתום טכנולוגיות חדשות לאיסוף מידע בניסויים קליניים – דוגמת מידע פיזיולוגי הנאסף באמצעות התקנים לבישים חכמים4 (wearables).
ישראל יכולה להוביל בעידן הרפואה המותאמת אישית
כשם שהשינויים הטכנולוגיים המתוארים יכולים להיות נקודת המפנה של תעשיית הביופארמה העולמית, גם בישראל הם מייצרים הזדמנות לפריצה המיוחלת של תעשיית הביופארמה המקומית ולצמיחתו של אקוסיסטם רב-תחומי חדש.
לאורך השנים, תעשיית הביופארמה בישראל לא מימשה את הפוטנציאל המדעי הגדול שלה: מרבית התרופות שהתגלו בארץ פותחו בחו”ל על ידי חברות זרות,5 והמשק הישראלי הפסיד חברות רווחיות ותעסוקה איכותית. האקזיט הענק של חברת Kite Pharma ב-2017, בסך כ-12 מיליארד דולר, הוא דוגמה בולטת לכך: מוצרי החברה מבוססים על פיתוח מדעי במכון וייצמן והעומד בראשה הוא ישראלי לשעבר, אולם כל פעילותה מתנהלת בארצות הברית. מספר חברות ביופארמה חדשניות ישראליות שהחלו לפעול בשני העשורים האחרונים אמנם העפילו בשנים האחרונות לשלבי פיתוח מתקדמים, אולם רובן לא הצליחו עדיין להגיע למכירות משמעותיות.
מקור: IVC
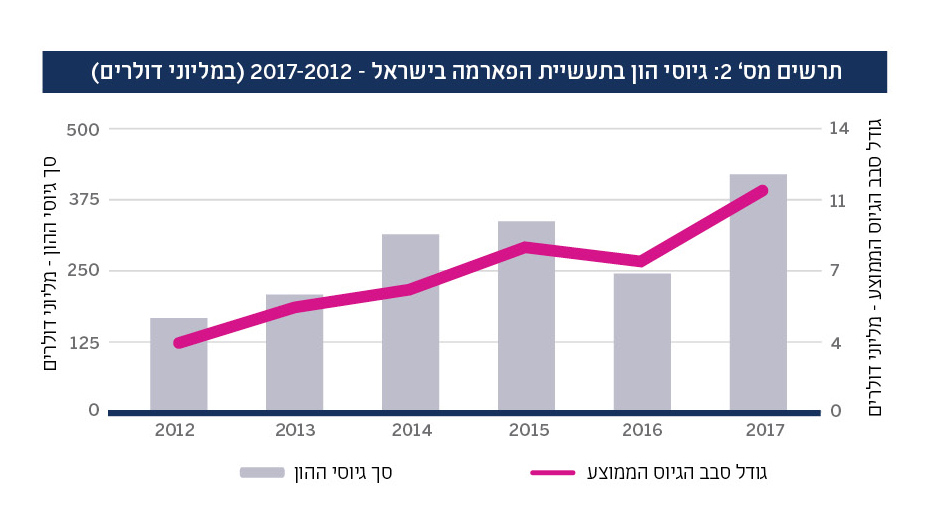
עם זאת, התמורות בתעשייה המקומית בשנים האחרונות מצביעות על מומנטום חיובי. תעשיית הביופארמה בישראל מונה כיום כ-200 חברות,6 ונוספות אליה מדי שנה כ-15 חברות חדשות.7 היקף ההשקעות בתחום עלה משמעותית בשנים האחרונות, וסבב הגיוס הממוצע עלה פי שלושה (ראה תרשים מס’ 2). בפרט, השקעותיהן של קרנות הון סיכון ישראליות בתחום עלו ב-400 אחוזים בין 2012 ו-2017. עלייה זו משקפת, בין היתר, את הצטרפותן של קרנות חדשות המתמחות בתחום ואת הקמתם של גופי השקעות נוספים, דוגמת חממת FutuRx הנתמכת על ידי רשות החדשנות.
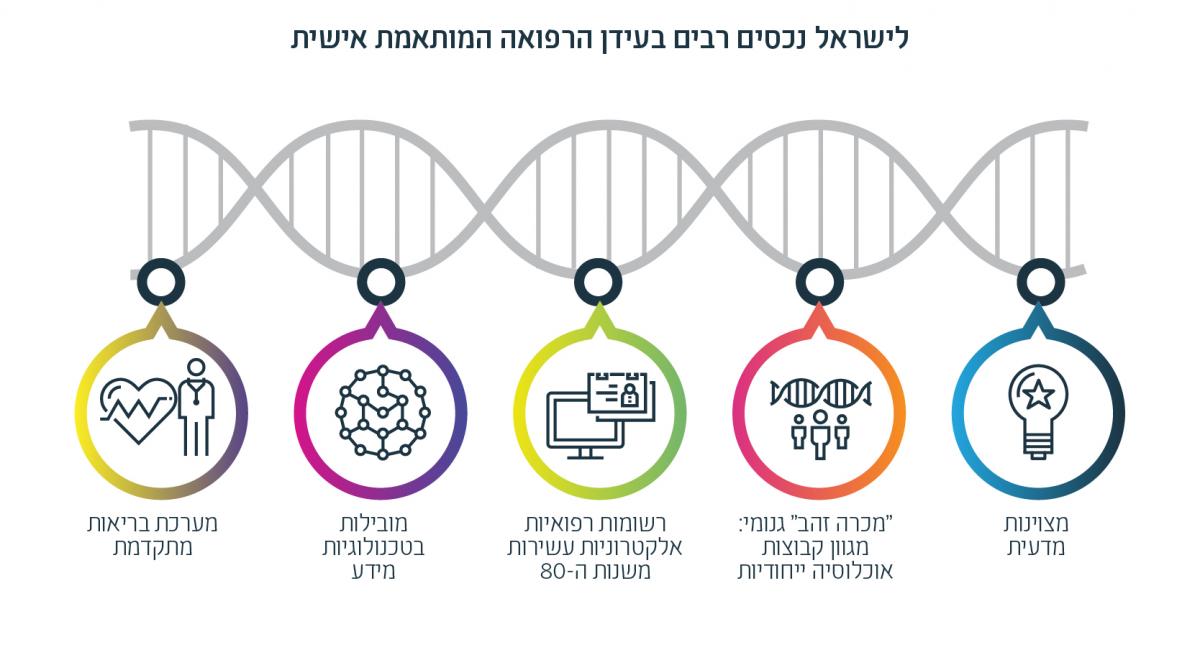
עידן הרפואה המותאמת אישית עשוי להיות פריצת הדרך של תעשיית הביופארמה הישראלית, על בסיס מספר נכסים המרכיבים יתרון תחרותי ייחודי. נכס מרכזי הוא המצוינות המדעית ארוכת השנים. פיתוחים שיצאו מהאקדמיה הישראלית אחראיים ל-8 תרופות חדשניות שנמכרו בכ-40 מיליארד דולר,8 וקהיליית המדע בישראל מצטיינת בחקר הסרטן, באימונולוגיה ובחקר מחלות ניווניות – תחומים שמצויים כיום במוקד פיתוח טיפולים בגישת הרפואה המותאמת אישית. לכך מצטרפים מקורות מידע רפואי וגנומי ייחודיים. בישראל מתגוררות מגוון קבוצות אוכלוסייה ייחודיות בשטח גאוגרפי קטן – עובדה שהופכת אותה ל”מכרה זהב” גנומי, והרשומות הרפואיות האלקטרוניות בישראל (EHR), אשר קיימות כבר משנות ה-80, מכסות את רובה המוחלט של האוכלוסייה. ברקע, המובילות הישראלית בטכנולוגיות מידע וחישוביות מאפשרת מינוף של המידע הרפואי והגנומי, ומערכת הבריאות המתקדמת מספקת פלטפורמה לשיתופי פעולה פוריים.
יתרון תחרותי זה הוא משמעותי לאורך כל תהליך פיתוח התרופה, והוא חשוב במיוחד בשלב גילוי התרופות ובשלבי הפיתוח הקליני. כדי לממש אותו, יש לפעול לחיזוק החיבור בין תחומי המחקר הרלוונטיים, להנגיש את תשתיות המידע והמחקר השונות הנחוצות לתעשייה, ולעודד השקעה בטכנולוגיות פורצות דרך – ביולוגיות, חישוביות ומשולבות. לצד זאת, אין להפחית מחשיבותן של מיומנויות טכנולוגיות ועסקיות “מסורתיות” הנדרשות עדיין בתעשיית הביופארמה. לפיכך, במקביל לחיזוק היתרון המתואר, יש לבחון מה מעכב את הצלחתן של חברות ביופארמה בישראל כיום ולפעול להסרת החסמים הרלוונטיים.
גילוי תרופות
גילוי תרופות בגישת הרפואה המותאמת אישית מבוסס על סריקת נתונים גנומיים וקליניים בהיקף אדיר למציאת אתרי מטרה חדשים וספציפיים לקבוצות אוכלוסייה מסוימות. לפיכך, בשלב זה השילוב בין המידע הגנומי והקליני בישראל ויכולות החישוביות נושא פוטנציאל גבוה.
בתעשייה הישראלית פועלות כבר כיום חברות חדשניות העוסקות בגילוי תרופות בשיטה זו. חברת איילה (Ayala Pharmaceuticals) פיתחה טיפול מותאם אישית לקבוצת חולי סרטן ספציפית הנושאת מוטציה גנטית, על בסיס מרקר דיאגנוסטי שזוהה דרך מידע קליני וגנומי. חברת אימפקט ביו (Immpact Bio), שהוקמה בחממת FutuRx הנתמכת על ידי רשות החדשנות, מפתחת טכנולוגיה להשריית תאים של מערכת החיסון (CAR-T) שיתקפו תאי סרטן מבלי לפגוע בתאים בריאים בגוף המטופל. הטיפול שהיא מפתחת יותאם באופן אישי לחולה תוך שימוש בכלים מתחום הביואינפורמטיקה ובמאגרי נתונים המבוססים על דגימות חולים. דוגמה נוספת היא חברת סייטוריזן (CytoReason) השואפת לגלות תרופות באמצעות ניתוח מידע ביולוגי על בסיס מודל מבוסס למידת מכונה (machine learning) של המערכת החיסונית. לפעילות בתעשייה מצטרפים מרכזי מחקר רב-תחומיים באקדמיה, דוגמת המרכז הישראלי לרפואה מותאמת אישית במכון וייצמן המשלב ביואינפורמטיקה בגילוי תרופות.
פעילויות אלו באקדמיה ותעשייה זכו לאחרונה לרוח גבית ממספר צעדים ממשלתיים. צעד מרכזי שנוקטת הממשלה הוא הקמת מיזם פסיפס. במסגרת המיזם, המוקם בשיתוף פעולה בין רשות החדשנות, משרד הבריאות, ות”ת-מל”ג והמשרד לשוויון חברתי, תוקם תשתית מידע גנומי וקליני חדשה הן לטובת מחקר אקדמי והן לטובת פיתוח מוצרים ושירותים בתעשייה.
במקביל, רשות החדשנות, במימון משותף עם מטה ישראל דיגיטלית במשרד לשוויון חברתי, מקימה בימים אלה איגוד משתמשים לבריאות דיגיטלית – שישמש כמערך תשתיות מידע רפואי משותף לתעשייה. האיגוד, בו ישתתפו חברות הזנק, חברות בינוניות וגדולות ואף חברות רב-לאומיות, יפעל להנגשה ושיתוף מידע רפואי קיים וחדש ויגבש תשתית רגולציה ואבטחת מידע סביב המידע. האיגוד יפעל בשיתוף פעולה עם גופים ישראלים – אקדמיים וקליניים – ובינלאומיים. הן מיזם פסיפס והן איגוד המשתמשים צפויים להביא לקפיצת מדרגה בתחום המידע הרפואי בישראל וכך לתת דחיפה נוספת לחברות קיימות מסוג זה ולסייע להקמתן של חברות חדשות.
לצד זאת, כיוון שפריצות דרך רבות בגילוי תרופות מתבצעות באקדמיה, יש להבטיח שתהליכי העברת הידע מהאקדמיה לתעשייה יפעלו כראוי. במסגרת היוועצות רחבה שערכה רשות החדשנות בשנה האחרונה עם התעשייה ועם האקדמיה למיפוי חסמים לצמיחה בתעשיית הביופארמה, עלה כי שלב המחקר התרגומי, כלומר תהליך הבאת התגלית המדעית לכדי התחלת פיתוח תרופה מסחרית, לוקה בחסר. בפרט, עלה כי חסרה בתהליך זה מעורבות מוקדמת של גורם תעשייתי-עסקי, המומחה בסינון פרויקטים אקדמיים, בתכנון ניסויים מתאימים לבחינתם ובפיתוח מעבדתי תעשייתי. רשות החדשנות מגבשת בימים אלו, יחד עם כלל הגורמים הרלוונטיים, מתווה לטיוב תהליך המחקר התרגומי בישראל. בין היתר, הרשות תפעל לשיפור מנגנוני הבחינה והסינון של טכנולוגיות הנולדות במחקר הבסיסי ונתמכות על ידיה בשלבי המחקר היישומי, ולמשיכת מומחים בינלאומיים במחקר תרגומי לישראל כדי לעודד זליגת ידע לתעשייה המקומית בתחום זה.
ניסויים קליניים
המגמות העולמיות בתחום הניסויים הקליניים מאפשרות למנף את היתרון התחרותי הישראלי להצלחתן של חברות ישראליות המפתחות תרופות, להתפתחות אקוסיסטם שלם התומך בניסויים קליניים בישראל ואף להפיכת ישראל למוקד עולמי לניסויים קליניים.
עבור חברות ביופארמה ישראליות, המעבר משלבי הפיתוח הפרה-קליני והפיתוח הקליני המוקדם לשלב הוכחת יעילות התרופה בחולים מהווה כיום עמק מוות. קשיי המימון בהם החברות נתקלות, יחד עם מחסור במנהלי תהליכים רגולטוריים מנוסים, מביאים לכך שהמידע הקליני שהן מייצרות לעיתים קרובות אינו מספק את הרגולטור. אך מגמות השינוי המתוארות בתכנון וביצוע ניסויים קליניים בעולם כולו פותחות פתח לשיפור משמעותי בהישגיהן של חברות הזנק ישראליות בשלב זה. בחירה מושכלת של אוכלוסיית הניסוי על בסיס מידע קליני וגנומי, ובמקביל פתיחות רגולטורית לאישור מהיר יותר של טיפולים מותאמים אישית, בעיקר לסרטן – יאפשרו לצלוח כל שלב עם היקף מצומצם בהרבה של מטופלים, ואף לבצע חלק גדול יותר מהתהליך הקליני בישראל. פירוש הדבר הוא שחברות ביופארמה ישראליות שישכילו לרתום את מגמות השינוי יוכלו להגיע לשוק בעלות נמוכה יותר ובמהירות גבוהה יותר.
הצעדים שנזכרו להנגשת מידע גנומי וקליני לתעשייה צפויים לסייע לחברות ביופארמה גם בשלב הניסויים הקליניים, ובפרט בבחירת אוכלוסיית הניסוי. במקביל, כדי להבטיח ניצול מיטבי של ההזדמנות המתוארת בתעשייה בישראל, רשות החדשנות תגדיל את שיעור תמיכתה בשלבים קליניים מוקדמים עבור ניסויים יעילים וחכמים התואמים את המגמה העולמית.9 כמו כן, הרשות תפתח תמריצים למשיכת מומחים עולמיים בניהול תהליכים רגולטוריים לאקוסיסטם הישראלי.
לצד זאת, הביקוש העולמי לטכנולוגיות מידע מתקדמות התומכות בשלבי הפיתוח הקליני, והצורך לבחון טיפולים מותאמים אישית באוכלוסיות מסוימות – יכולים להביא להתפתחות אקוסיסטם שלם התומך בניסויים קליניים בישראל. גם חברות הביופארמה הישראליות עשויות להרוויח ממגמה זו, משום שיתגבש ידע מקומי אודות ניהול וביצוע ניסויים קליניים. כבר כעת, מגוון חברות בתעשייה הישראלית מזהות את הצורך בפתרונות טכנולוגיים מתקדמים לבחינת השפעתן של תרופות ונכנסות לתחום. חברת Pilltracker, לדוגמה, פיתחה פתרון ניטור אלקטרוני המאפשר לעקוב באופן מדויק אחר נטילת התרופה על ידי משתתפים בניסוי קליני, לעדכן אותם על שינוי מינון ולקבל מהם פידבק שוטף. מנגד, חברת Data2Life מתחברת למגמה העולמית של בחינת השפעת תרופות לאחר שיווקן (real-world data). החברה אוספת מידע שמייצרים מטופלים במגוון ערוצים: מדיה חברתית, מכשירי ניטור רפואיים, רשומות רפואיות, מידע מניסויים קליניים ועוד, ומייצרת ממנו תובנות אודות השפעתה של התרופה ותופעות הלוואי שלה דרך אלגוריתמי למידת מכונה ועיבוד שפה טבעית (Natural Language Processing).
ישראל אף יכולה להפוך למוקד לביצוע הניסויים עצמם. בתי חולים מחקריים איכותיים, טיפול רפואי מתקדם, ניסיון בעריכת ניסויים וממדיה הקטנים של המדינה אשר מקלים על גיוס חולים, הופכים אותה לאטרקטיבית כבר כיום לחברות הביופארמה הגלובליות. לראיה, בשנת 2017 הגישו חברות למעלה מ-1,500 בקשות לעריכת ניסויים קליניים בבתי חולים בישראל.10 חדירתה של גישת הרפואה המותאמת אישית ומגמות הדיגיטציה בניסויים קליניים יכולה לחזק את מעמדה של ישראל בתחום זה. ראשית, מגוון קבוצות האוכלוסייה הייחודיות בישראל הוא אטרקטיבי מאוד לביצוע ניסויים בטיפולים מותאמים אישית המבוססים על מוטציות גנטיות (דוגמת מקרה מאגר הנתונים של חולי פרקינסון בישראל). שנית, הובלה בטכנולוגיות מידע מסייעות לניסויים קליניים תאפשר לאקוסיסטם הישראלי לספק שירותים חדשניים לחברות ביופארמה שיבצעו ניסוים קליניים בישראל.
לסיכום, רשות החדשנות רואה בגישת הרפואה המותאמת אישית נקודת מפנה פוטנציאלית לתעשיית הביופארמה הישראלית. שינויי העומק בתעשיית הביופארמה העולמית מייצרים הזדמנות לפריצת המחיצות בין עולם הביופארמה הקלאסי ובין תעשיית ה-ICT ולצמיחתם של שחקנים חדשים ומתמחים. עלינו לרתום את המגמות הטכנולוגיות העולמיות ולפתח אקוסיסטם רב-תחומי אשר יונע על ידי מדע פורץ דרך, יעשה שימוש מיטבי במידע הגנומי והקליני הקיים בישראל, וימנף טכנולוגיות מידע מתקדמות, ולהבטיח שעתיד תעשיית הביופארמה העולמית יתחיל בישראל.
הערות שוליים:
1 Deloitte. (2018). A new future for R&D? Measuring the return from pharmaceutical innovation 2017
2 Scott, A. (2018, March 7). How CRISPR is transforming drug discovery
3 שינוי פרדיגמה שמוביל ה-FDA באישור תרופות חדשות הופך מידע שנאסף על פעולתן של תרופות חדשות ב”עולם האמיתי” – כלומר, לא במסגרת ניסוי קליני מבוקר – לקריטי
4 The Economist. (2018, March 24). FDA Wants to help unproductive drug makers
5 יוצאת דופן היא הקופקסון של חברת טבע
6 נתוני IVC
7 נתוני IVC – ממוצע בין השנים 2012 ו-2017
8 נכון ל-2014
9 בהיוועצות עם התעשייה עלה שתמיכה ממשלתית בשלבים הקליניים המוקדמים נדרשת יותר ואפקטיבית יותר לחברות מאשר בשלבים המתקדמים
10 אישורי הועדה להתקשרויות עם חברות מסחריות ,סיכום שנת 2017 והשוואה לשנים 2014-2016, 15 במאי 2018, משרד הבריאות